Plantes panachées et multiplication in vitro
La maîtrise de la multiplication in vitro (MIV) de jeunes plants est stratégique pour la diffusion rapide des nouveautés. La production ayant été massivement délocalisée dans des pays à bas coût de main-d’œuvre (Europe de l’Est, Turquie, Asie du Sud…), peu de laboratoires commerciaux de MIV sont opérationnels en France. Près d’Angers, le Laboratoire angevin des plantes (LAP), issu des Pépinières André Briant Jeunes Plants (ABJP), produit annuellement plus de 1,2 million de plants, dont une partie est surbouturée pour un total de 2,2 millions de plants issus directement ou indirectement d’in vitro.

Le Laboratoire angevin des plantes (LAP) en collaboration avec l’IRHS (Institut de recherche en horticulture et semences) conduit un projet de recherche qui vise à maîtriser la stabilité du phénotype au cours de la multiplication de plantes acaules à feuillage panaché, un produit à forte valeur ajoutée.
Il existe une grande diversité de phénotypes de feuilles panachées, qui est la juxtaposition de plusieurs couleurs sur un même organe, feuille ou pétale par exemple. Il peut s’agir de feuillage tricolore (Pelargonium × hortorum ‘Mrs Pollock’) ou bicolore : parties claires sur les marges (Yucca gloriosa ‘Variegata’, Figure n° 1) ou sur la zone centrale de la feuille (Yucca flaccida ‘Golden Sword’, Figure n° 1) ou réparties sous forme de taches (Dracaena surculosa ‘Florida Beauty’, Figure n° 1). La répartition des couleurs peut être très complexe, avec l’exemple de Sansevieria trifasciata ‘Laurentii’ (Figure n° 1) dont les feuilles sont vert foncé avec des bandes transversales de couleur vert gris et des marges jaune crème.
CI-DESSUS
Figure n° 1 : Différents types de panachure chez les plantes ornementales
Panachure : origines multiples et stabilité
Les causes de ce phénomène de panachure (1*) peuvent être multiples (Marcotrigiano, 1997). Ainsi, il peut y avoir une origine anatomique modifiant localement la perception des couleurs (ex : Pilea cadieri, Figure n° 2). La cause peut être virale, certains virus provoquant des décolorations localisées (ex : Abutilum pictum ‘Thompsonii’, Figure n° 2). La panachure peut être due à une expression différenciée des gènes dans les tissus (ex : les zonations pourpres de certains cultivars de Pelargonium × hortorum) pouvant être d’origine génétique ou épigénétique. Un travail récent (Wang et al., 2016) a mis en évidence, pour la première fois, une corrélation entre le taux de méthylation de l’ADN (modification épigénétique) et la panachure de Clivia miniata ‘Variegata’ (Figure n° 2). Enfin, l’association de plusieurs génotypes au sein des méristèmes apicaux d’un même individu peut produire des tissus de coloris différents au sein d’un même organe. On parle alors de mosaïque génétique ou de chimère.
Chez l’ensemble des dicotylédones et de nombreuses monocotylédones (Stewart and Dermen, 1979), le méristème apical comprend trois couches cellulaires appelées L1, L2 et L3 (Figure n° 3, Frank and Chitwood, 2016).
Seules les chimères périclines (2*) peuvent être maintenues à l’identique au cours de la multiplication si celle-ci est réalisée avec une méthode conservant la disposition des couches cellulaires au sein des méristèmes aériens : bouturage de tiges et multiplication in vitro par développement de bourgeons préexistants. La multiplication in vitro par organogenèse adventive (néoformation de bourgeons) et embryogenèse somatique régénérera des plantes à partir d’un faible nombre de cellules. La structure de chimère péricline ne sera pas maintenue.
Selon les cultivars, la stabilité des panachures peut être très différente au cours du processus de multiplication. Un lien entre origine (déterminisme) de la panachure et mode de multiplication appliqué est parfois mis en évidence. Une organogenèse adventive in vitro de Dracaena marginata ‘Tricolor’ a généré des plantes ayant perdu la panachure (Chua et al., 1981) alors que celle de Dracaena surculosa ‘Flordida Beauty’ a été maintenue, (feuilles vertes parsemées de taches irrégulières jaunes) (Liu et al., 2010). Les auteurs concluent sur la présence d’une chimère péricline pour D. marginata ‘Tricolor’ et une autre origine, non déterminée, pour Dracaena surculosa ‘Flordida Beauty’.
Le cultivar ‘Candy Lou’ de Saintpaulia ionantha se caractérise par deux types de panachures : des feuilles panachées vert et blanc et des fleurs panachées rose et blanc. Après régénération in vitro par organogenèse adventive, les plantes ont des feuilles conformes au phénotype de départ mais avec des fleurs uniformément roses dans 76 % des cas. Les deux panachures n’ont donc pas le même déterminisme, celle des fleurs serait liée à un état de chimère (Peary et al., 1988). Divers mécanismes peuvent donc conduire à un phénotype « feuillage panaché » et il est important d’identifier le déterminisme d’une panachure pour raisonner la stratégie de multiplication et maîtriser la stabilité du phénotype.
CI-DESSUS
Figure n° 2 : Exemples de panachure due à une origine morphologique (Pilea cadieri), virale (Abutilon pictum ‘Thompsonii’) ou épigénétique (Clivia minata ‘Variegata’)
Comment mieux comprendre ce phénomène ?
Un projet de thèse, co-encadré par le LAP et l’IRHS, a démarré en 2017. Dans un premier temps, la stabilité du caractère panaché au cours des cycles de multiplication in vitro a été évaluée pour différents cultivars : Yucca filamentosa ‘Bright Edge’ (Figure n° 4), Yucca flaccida ‘Golden Sword’ (Figure n° 1), Yucca gloriosa ‘Variegata’ (Figure n° 1), Phormium tenax ‘Jessie’ (Figure n° 4) et Cordyline australis ‘Pink Passion’ (Figure n° 4). Le taux de conformité est proche de 100 % pour les yuccas, tandis qu’il peut descendre à 75 % pour le phormium et à 40 % pour la cordyline après six cycles. L’origine de la perte de la conformité a été étudiée par deux approches : une étude histologique de l’origine des plants et une étude comparative du transcriptome entre tissu panaché et non panaché.
CI-DESSUS
Figure n° 4 : Différentes espèces testées en MIV (multiplication in vitro) pour évaluer le maintien de la conformité de la panachure des feuilles.
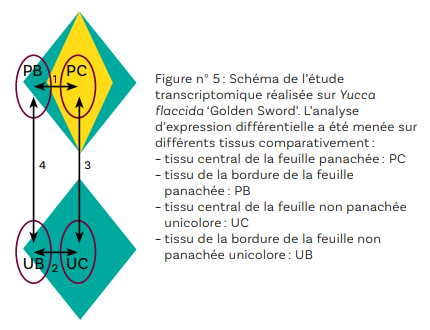
L’étude histologique a permis de montrer que le développement de méristèmes axillaires préformés conduit au maintien de la panachure (cas des yuccas) alors que la néoformation de méristèmes (cas de la cordyline) entraîne l’apparition de plants non conformes. L’analyse transcriptomique a été menée sur un plant du cultivar Yucca flaccida ‘Golden Sword’ conforme (panaché : P) et sur un plant non conforme aux feuilles uniformément vertes (uni: U) obtenu à partir de ‘Golden Sword’. Quatre tissus ont été comparés (deux pour la feuille panachée : le tissu de la partie centrale, le tissu de la bordure, et deux pour la feuille unicolore : le tissu de la partie centrale, le tissu de la bordure de la feuille, Figure n° 5). Ces travaux, en cours d’analyse, permettront de montrer quels gènes sont surexprimés ou sous-exprimés selon les tissus. Cette étude permettra de définir la (les) voie(s) de régulation affectée(s) chez les plantes panachées et non panachées de ce génotype.
Conclusion
Les génotypes panachés sont divers et précieux en horticulture ornementale. Les causes et la stabilité de ce caractère sont différentes d’un cultivar à un autre. Le travail réalisé dans le cadre d’une thèse montre cette variabilité. Une approche histologique a permis de relier l’origine d’un plant et la perte de conformité. Les données d’expression différentielle de gènes permettront de mieux comprendre les voies touchées par ce phénomène chez une variété de Yucca.
Laurence Hibrand-Saint-Oyant
Ingénieure de recherche, IRHS/Inrae
Gilles Colinet
Directeur d’Anjou Briant Jeunes Plants et gérant du Laboratoire Angevin des Plantes
Alexandre Rouinsard
Doctorant Laboratoire Angevin des Plantes/IRHS/Agrocampus Ouest
Agnès Grapin
Maître de conférences IRHS/Agrocampus Ouest
(1*) Panachure : juxtaposition de plusieurs couleurs sur un même organe, feuille ou pétale par exemple.
(2*) Chimère péricline : les cellules mutées sont regroupées suivant les assises cellulaires. Par exemple, c’est l’ensemble des cellules de la couche L2 qui sont différentes (Figure n° 3).
BIBLIOGRAPHIE
Frank MH and Chitwood DH. Plant Chimeras: The Good, the Bad and the ‘Bizzaria’. Developmental Biology 2016;419:41–53
Liu, JX et al. Regeneration of Dracaena surculosa Through Indirect Shoot Organogenesis. Hortscience. 2010;45:1250-1254
Marcotrigiano, M. Chimeras and Variegation: Patterns of Deceit. Hortscience 1997;32:773-784
Stewart, R.N. and Dermen, H. Ontogeny in Monocotyledons as Revealed by Studies of the Developmental Anatomy of Periclinal Chloroplast Chimeras. American Journal of Botany. 1979;66:47-58
Wang QM. et al. Leaf Patterning of Clivia miniata var. variegata Is Associated with Differential DNA Methylation. Plant Cell Reports 2016;35:167-184
