Du parasitisme chez les plantes : vivre de rapines dans le règne végétal
Marc-André Sélosse
La Rochefoucauld prétendait, en ses Maximes, que pour l’homme, « il n’y a au monde que deux manières de s’élever, ou par sa propre industrie, ou par l’imbécillité des autres ».
Il en va de même pour les plantes : elles peuvent assurer leurs fonctions par elles-mêmes ou par d’autres plantes dont elles exploitent les faiblesses.
Qu’est-ce que le parasitisme ?
Un parasite est un organisme qui tire un avantage d’une relation avec une autre espèce, qu’on appelle son hôte, alors que celui-ci est plus ou moins défavorisé par cette relation. Il ne faut pas être naïf sur la nature du coût. Une première approche, purement agronomique, serait d’imaginer que ce coût présente un impact sur la croissance. Mais alors, que penser d’une galle (Fig. 1), où les tissus de l’hôte prolifèrent sous l’effet d’un parasite, champignon, acarien ou insecte ? Ici la croissance ne profite plus à l’hôte, mais elle est détournée au profit du parasite que ces tissus charnus protègent et nourrissent ! Ainsi, la croissance seule renseigne souvent mal sur l’interaction. En termes évolutionnistes, on préfère prendre en compte l’effet sur la descendance. En effet, du nombre de descendants dépend la survie évolutive. On parle de la valeur sélective ( fitness en anglais). Un parasite améliore sa valeur sélective aux dépens de celle de son hôte. Il détourne les ressources ou les organes à son avantage et endommage l’un et/ou l’autre des deux composantes de la valeur sélective de l’hôte : sa longévité (donc le nombre d’années de reproduction) et sa fertilité (le nombre de descendants par an)1.
Parce qu’elles sont vertes, on voit souvent les plantes comme autotrophes, c’est-à-dire nourries de leur photosynthèse. Or, de nombreux parasitismes reposent sur le « vol » de matière organique à d’autres organismes. Dans l’évolution, en effet, la capacité à effectuer la photosynthèse est fluctuante, et entretient avec le parasitisme des liens complexes. Remontons aux origines.
Devenir vert : l’acquisition de la photosynthèse
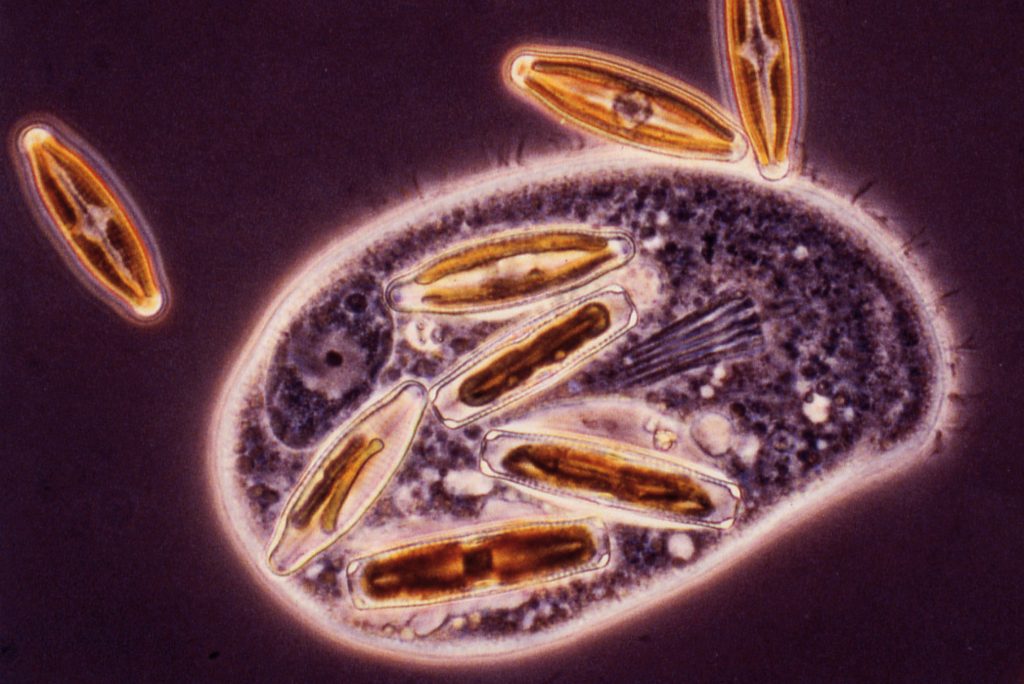
L’acquisition de la photosynthèse est le fait d’un lointain ancêtre des plantes. Il y a bien longtemps, des unicellulaires hétérotrophes sont devenus photosynthétiques : ces cellules ancestrales avalaient, par phagocytose, des cellules proies condamnées à être digérées.
Cette prédation est un cas extrême de parasitisme. C’est encore le mode de vie de certaines amibes et des paramécies (Fig. 2).
C’est de cette situation qu’est advenue la photosynthèse : des bactéries photosynthétiques (les cyanobactéries), capturées ainsi, ont établi une association durable avec la cellule qui les avait phagocytées. Non digérées, ces proies non seulement ont persisté dans leur nouvel hôte, mais en plus, elles s’y sont multipliées. En échange du gîte et de tous les aliments minéraux requis à leur survie, ces petits habitants sont devenus source des sucres de leur cellule hôte. Du parasitisme, on était passé à une symbiose.
Cette histoire-là s’est produite une première fois entre un unicellulaire et une cyanobactérie, et la cellule ainsi formée a engendré de nombreuses espèces actuelles : les algues rouges, les algues vertes et les plantes terrestres. L’histoire a ensuite bégayé de nombreuses fois. D’autres cellules vivant de phagocytose ont avalé une algue unicellulaire, qui est devenue leur plaste : c’est le cas des algues brunes (dont les fucus et autres laminaires) et d’algues moins visibles comme les diatomées, ou les dinoflagellés (parfois toxiques, elles sont responsables d’interdictions de consommation des huîtres qui les accumulent). Ainsi des hétérotrophes sont devenus, à plusieurs reprises, autotrophes par symbiose. Ainsi sont nées diverses lignées dites « végétales », capables de photosynthèse. Ainsi, des prédateurs, parasites de populations photosynthétiques, sont-ils devenus autotrophes. Mais l’histoire n’est pas linéaire : tous ne le sont pas restés.
Rester vert ? Le retour à l’hétérotrophie
Parmi les groupes d’algues, de nombreux retours à l’hétérotrophie témoignent de cette instabilité. Parmi les dinoflagellés, certains ont perdu la photosynthèse et sont redevenus prédateurs de cellules photosynthétiques, tandis qu’un groupe voisin vit à présent en parasite des animaux : les apicomplexes (ou sporozoaires), parmi lesquels les agents de la malaria et de la toxoplasmose.
Les plantes ne font pas exception : certaines, redevenues non chlorophylliennes et hétérotrophes, se nourrissent en parasites. Il en existe deux modalités. L’une, apparue une douzaine de fois et concernant plus de 400 espèces, parasite les plantes voisines à l’aide de suçoirs qui, insinués dans les tissus de l’hôte, ponctionnent la sève brute et la sève élaborée. Ce sont les plantes holoparasites, comme les orobanches et les lathrées (Fig. 3a). L’autre modalité est apparue au moins 47 fois (en particulier parmi les orchidées, Fig. 3b) et englobe plus de 520 espèces : ces plantes, dites mycohétérotrophes, parasitent… des champignons mycorhiziens colonisant leurs racines. Les plantes mycohétérotrophes exploitent le carbone de ces champignons ! Comme le signifie leur nom en grec, elles sont hétérotrophes grâce à des champignons. L’effet exact sur le champignon reste mal décrit, mais on considère souvent qu’il s’agit d’un parasitisme.
Trompeusement vertes : les mixotrophes
Outre ces extrêmes qui ont perdu la photosynthèse, certaines plantes vertes sont parasites tout en conservant une photosynthèse plus ou moins efficace : on parle de mixotrophie pour cette stratégie mélangeant autotrophie et hétérotrophie parasitaire. On retrouve les deux stratégies décrites plus haut. Certaines plantes vertes complètent leur photosynthèse et leurs besoins en sels minéraux en parasitant les racines ou les tiges d’autres plantes : dans nos régions, c’est respectivement le cas des rhinanthes et des cuscutes. On parle d’hémiparasites, et ceux-ci n’exploitent bien souvent que la sève brute de leur hôte, surtout riche en sels minéraux, mais non complètement dénuée de sucres. D’autres plantes, également vertes, exploitent en partie le carbone de leurs champignons mycorhiziens : ces espèces partiellement mycohétérotrophes, comme les pyroles (Ericacées) ou des orchidées, s’adaptent ainsi à la vie en sous-bois faiblement éclairés.
D’un point de vue évolutif, les espèces parasites sans chlorophylle envisagées plus haut sont dérivées d’ancêtres mixotrophes qui ont basculé dans l’hétérotrophie complète. Au-delà de l’opposition entre autotrophie et hétérotrophie se déploient donc tous les degrés de parasitisme et d’hétérotrophie…
Des chaos de l’évolution
Au cours de l’évolution, rien n’est acquis durablement. C’est ce que montrent ces plantes qui, le plus souvent autotrophes, dérivent d’ancêtres parasites et ont retrouvé le chemin du parasitisme. Leur coût est bien sûr élevé pour leurs hôtes. Les pertes de céréales et de légumineuses parasitées par Striga hermonthica en Afrique subsaharienne atteignent dix milliards d’euros, tandis que les attaques par des orobanches au Moyen-Orient réduisent la production de 20 à 100 %. Ceci illustre bien les effets sur la production de graines, donc sur la valeur sélective.
À toute chose malheur est bon cependant : plus riches en azote et/ou en phosphore, qu’elles extraient en abondance de leurs hôtes, les plantes parasites sont mieux décomposées et augmentent le recyclage minéral dans le sol. Lorsqu’elles parasitent des espèces dominantes, elles favorisent une biodiversité qui n’existerait pas sans elles. Enfin elles nourrissent des cortèges de pollinisateurs (Fig. 4) et de disperseurs de leurs fruits. Parasites des uns, elles profitent à d’autres et occupent une place à part entière, pas seulement néfaste, dans nos écosystèmes.





