L’apomixie : un mode de reproduction plus courant qu’il n’y paraît
Yves Savidan
Dans le monde animal comme dans le monde végétal, l’essentiel est de vivre et de se reproduire. Les plantes disposent d’un arsenal de solutions pour perpétuer l’espèce. Parmi eux, l’apomixie.
Les pissenlits se multiplient très vite dans la pelouse si l’on ne s’occupe pas d’eux. L’herbe de la pampa peut sortir du jardin, poussée par le vent du nord, et partir coloniser le champ de l’autre côté de la route. Ces espèces présentent plusieurs caractéristiques qui contribuent à leur caractère envahissant, comme le grand nombre de graines qu’elles portent, ou leur faible poids, qui leur permet d’être emmenées très loin par le vent. Le mode de reproduction particulier de ces espèces participe également à leur pouvoir colonisateur : l’apomixie.
L’apomixie, comment ça marche ?
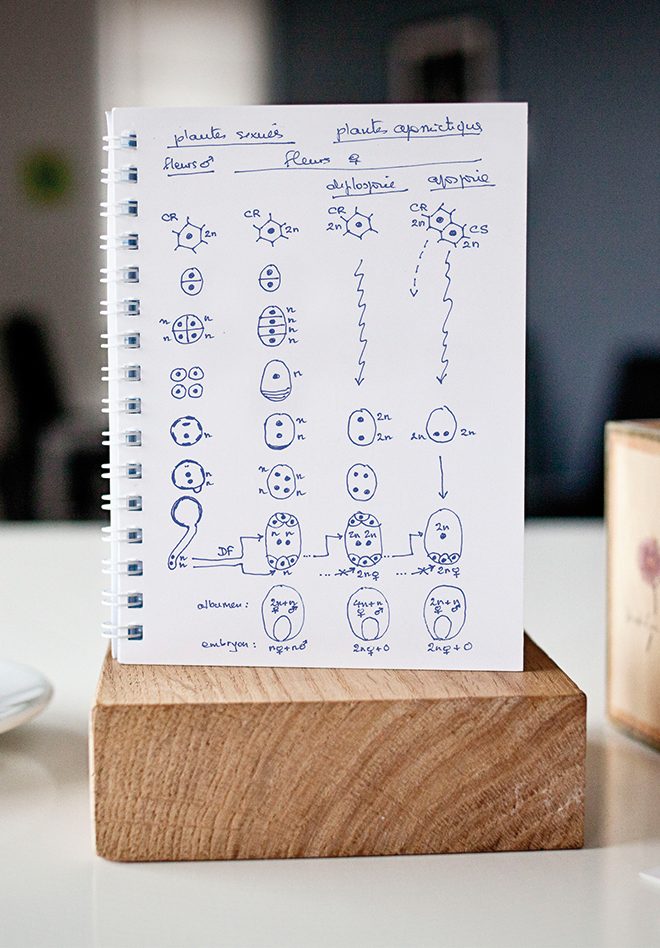
Les plantes apomictiques produisent des graines dont l’embryon est maternel. Un petit retour sur les étapes de la reproduction sexuée est nécessaire pour comprendre ce qui se passe chez ces plantes (Figure n° 1). Chez les plantes sexuées, la production d’une graine passe par deux étapes essentielles : la méiose et la fécondation. La méiose est la division cellulaire qui réduit le nombre de chromosomes – 2n chez la plante-mère, n chez les gamètes qui en sont issus – et permet la recombinaison chromosomique et donc l’hétérogénéité, c’est-à-dire la diversité d’une descendance. Elle a lieu aussi bien du côté mâle, avec la production de grains de pollen à n chromosomes, que du côté femelle, avec la production d’une autre structure haploïde (n chromosomes) qu’on appelle le sac embryonnaire. Dans celui-ci, deux cellules jouent un rôle essentiel au moment de la fécondation : l’oosphère, qui donne naissance à l’embryon (2n) après fécondation et fusion de deux gamètes (n femelle + n mâle), et l’albumen, qui provient de la fécondation, par le deuxième noyau pollinique, des deux noyaux de la cellule centrale du sac embryonnaire (2n femelle + n mâle). Chez les plantes apomictiques, le développement du pollen suit la même voie que chez les plantes sexuées. Seule la partie femelle de la fleur est affectée. Par souci de simplification, seuls les deux types d’apomixie les plus fréquents sont présentés dans les deux colonnes de droite de la Figure n° 1. Dans la première, le sac embryonnaire se développe à partir de la cellule reproductive, comme chez les plantes sexuées, mais celle-ci se développe directement en sac embryonnaire sans passer par la case méiose. La structure produite est donc « non réduite » : chaque noyau contenant les 2n chromosomes de la plante-mère. Ensuite, la double fécondation se résume à une simple fécondation, l’oosphère se développant en embryon sans qu’il y ait eu fusion de gamètes : l’embryon est donc maternel (2n femelle + 0). L’albumen, par contre, est toujours hybride, mais avec une contribution femelle doublée (4n femelle + n mâle). Ce type d’apomixie est appelé diplosporie. Dans la quatrième colonne du schéma, un ou plusieurs sacs embryonnaires se développent à partir de cellules somatiques. Toujours sans passer par la méiose, on assiste à la formation d’un sac embryonnaire non réduit, où chaque noyau contient les 2n chromosomes des cellules maternelles. C’est l’aposporie. Dans l’exemple choisi ici, qu’on appelle le type Panicum, du nom du genre où ce développement a été décrit pour la première fois, le sac embryonnaire n’a que quatre noyaux et un seul dans sa cellule centrale. La simple fécondation produit une graine avec un embryon maternel, mais avec un albumen hybride qui, comme chez les plantes sexuées, possède 2n chromosomes d’origine maternelle et n chromosomes d’origine mâle.
L’apomixie, comment ça marche ?
La jeune plantule qui naît à partir de l’embryon de la graine apomictique est donc une copie conforme de la plante-mère. On parle de clonage par voie de graines.
Ce clonage naturel existe dans de très nombreuses plantes à fleurs, puisque plus de 500 espèces, dans 45 familles différentes, semblent présenter cette capacité à produire des embryons maternels par apomixie. L’apomixie par aposporie est très fréquente chez les graminées tropicales (Panicoïdées) et on peut relier ce succès, aujourd’hui, au fait que l’albumen des graines possède les mêmes apports, quantitatifs, femelle et mâle que celui des plantes sexuées (2n + n).
Si les espèces apomictiques sont des clones, comment expliquer qu’on y observe une étonnante diversité où toutes les formes intermédiaires sont possibles ? L’étude de populations naturelles a démontré que cette diversité résultait de la coexistence de l’apomixie et de la sexualité au sein de l’espèce. Un très faible taux de sexualité est suffisant pour qu’il y ait hybridation – le pollen des apomictiques est normal et peut donc féconder une plante voisine qui serait sexuée – et créer ainsi de nouveaux génotypes. L’apomixie agit ainsi comme fixateur de toutes les formes hybrides intermédiaires.
Si la présence de diversité signifie qu’il y a présence de sexualité, il fallait d’abord trouver cette sexualité chez les espèces connues comme apomictiques. L’étude des Panicum en Afrique1 a montré que la formation de sacs embryonnaires à quatre noyaux maternels était une caractéristique qui se transmettait, par hybridation, comme le gène unique, dominant, de la couleur du petit pois de Mendel. L’apomixie, contrôlée par un seul gène, c’était une petite révolution aux multiples conséquences.
Où l’on en revient à Mendel…
Et en parlant de Mendel… on ignore généralement que l’histoire de la génétique de l’apomixie commence avec les travaux du célèbre moine lorsque celui-ci, après ses expérimentations sur les pois, décide de suivre une recommandation de Nägeli, avec lequel il correspond depuis 1866. Elle consiste à reproduire les mêmes expérimentations sur une autre plante à fleurs, l’épervière (Hieracium sp.). Après avoir croisé une plante à fleurs rouges avec une plante à fleurs jaunes, Mendel découvre que la première génération d’hybrides (F1), homogène chez les pois, est très hétérogène chez Hieracium, avec des fleurs de couleurs variées. Et la deuxième génération (F2), hétérogène (en ségrégation) chez les pois, est très souvent entièrement homogène chez l’épervière, toutes les fleurs étant rouges ou jaunes. Devant ce résultat aussi inattendu qu’inexpliqué, qui contredit tout ce qu’il avait trouvé jusqu’alors, on raconte que Mendel, dépité, arrêta toutes ses expérimentations. Ses nouvelles charges, liées à sa nomination à la tête du monastère de Brno en 1868, pesèrent certainement beaucoup plus dans sa décision. Il faudra attendre une quarantaine d’années pour qu’apparaisse un début d’explication. Un chercheur suédois découvre alors que la plante utilisée comme pollinisatrice dans le croisement entre Hieracium est une plante apomictique.
Et aujourd’hui ?
L’état des connaissances permet aujourd’hui de penser que l’apomixie résulte d’un démarrage anormalement précoce de la formation du sac embryonnaire. Si le signal est lancé très tôt, plusieurs cellules de l’ovaire présentent la capacité de former un sac (c’est l’aposporie). Un peu plus tard, seulement une cellule reproductive a cette capacité (diplosporie). Si le facteur temps est le facteur clé pour la production de gamètes non réduits, l’expression de l’apomixie dépend surtout de la formation d’un albumen viable permettant la croissance de l’embryon.
En montrant que l’apomixie peut être facilement transmise d’une génération à l’autre, on laisse entrevoir d’importantes applications pour l’agriculture. En effet, si un cultivar est apomictique, l’agriculteur n’a plus besoin de racheter des graines pour chaque nouveau semis. Mais pour l’instant, seuls les pâturages du Brésil bénéficient de ces connaissances. Ceci représente tout de même plus de 100 millions d’hectares aujourd’hui : une surface quatre fois supérieure à celle de l’agriculture en France.
À lire
Savidan Y., 1982. Nature et hérédité de l’apomixie chez Panicum maximum Jacq. Travaux et Documents ORSTOM, 153: 1-159.
Savidan Y., 2000. Apomixis: Genetics and Breeding. Plant Breeding Reviews 18: 13-86.
Savidan Y., 2001. Gametophytic Apomixis: A Successful Mutation of the Female Gametogenesis. In: Bhojwani S.S., and Soh W.Y., Current Trends in the Embryology of Angiosperms, Kluwer Academic Publishers, p.419-433.
1 Conduite à partir de 1965 en Côte-d’Ivoire par l’Office de la recherche scientifique et technique outre-mer (Orstom), devenu Institut de recherche pour le développement (IRD).